来 源:James Linder, MD
上传时间:2020.04.01
为了能够对涂片标本进行正确的诊断,标本内必须包含有足够数量的鳞状上皮细胞。根据 Bethesda 2001 会议制定的名词术语,建议将涂片测试分为“标本评估满意”或“标本评估不满意”两种类别。原 Bethesda 分类中的“满意,但有缺陷”类别已被删除。颈管/过渡区细胞存在与否的描述以及任何其他的标本质量因素均可作为“标本评估满意”的描述性因素,并可将其包括在内,但不对细胞量构成“限制”。要报告过渡区细胞存在,则应至少观察到十个保存良好的颈管细胞或鳞状化生细胞。如果标本显示出高度病变或癌症的迹象,则不必报告过渡区细胞是否存在。
标本评估满意
要将标本评估为满意标本,通常需要至少 5,000 个清晰可见/保存良好的鳞状细胞,同时应注意以下事项:
人们认识到严格的客观标准并不适用于所有的案例。例如:如果玻片上出现细胞团、委缩症或细胞溶解的情况,则在技术上便难以对细胞量进行计数;因此,试验室的工作人员在对这些玻片进行评估时,应施以专业判断,并进行分层评估。
在评估细胞结构时,并不需要对每个标本的细胞量进行计数。如果细胞学技师认为清晰可见/保存良好的鳞状细胞的存在数量不足 5000,则可按照以下内容对细胞量进行计数。
对于任何带有异常细胞的标本,均按照标本评估满意进行定义。 如果有必要对 ThinPrep 玻片上的鳞状细胞量进行计数,则: 1. 沿直径方向(包括涂片的中心),至少应有 10 个显微视野。如下表所示,每个显微视野的平均细胞量应达到 5000:
涂片直径 mm | 20 | |
N20 目镜/10X 物镜 | 视野区域的数量@FN20 10X | 100 |
FN20 目镜/40X 物镜 | 视野区域的数量@FN20 40X | 1600 |
FN22 目镜/10X 物镜 | 视野区域的数量@FN22 10X | 82.6 |
FN22 目镜/40X 物镜 | 视野区域的数量@FN22 40X | 1322 |
如果所使用的目镜未被列出,则公式为:
各显微视野所需的细胞数量 =
5000 /(圆的面积/目镜面积)
目镜直径或显微视野均以毫米为单位,是由目镜的视野数量除以物镜的放大倍数而得。这样,便可通过圆的面积公式 [pi X (半径的平方)] 来确定视野面积。
对于采用 ThinPrep®成像系统进行处理的玻片,应按照《操作手册》中的要求来确定细胞量。
根据 Bethesda 2001,可在说明栏内选择性地提供有关细胞量指标的含义以及任何有关患者随访内容的更多信息。对于经过处理和评估的“不满意涂片”,需要为其投入大量的时间和精力。虽然此类标本无法排除上皮病变的可能,但其所提供的一些有用信息(是否存在微生物感染等)有助于直接对患者进行进一步的管理。为对报告进行规范,Bethesda 2001 建议使用以下措辞:
A) 标本不能接受:
标本不能接受(不能处理),注明原因 ____(标本未贴标签、玻片破碎等)
B)标本评估不满意:
标本经过处理和检查,但上皮异常评估不满意,注明原因 ____(由于受到血细胞干扰,因而造成鳞状上皮不足等);并可在适当的情况下,提供更多的建议/建议
干扰因素
如果标本上有超过 75% 的细胞受到干扰,则应将其认定为不满意标本(假设没有出现异常细胞)。如果有 50-75% 的细胞受到干扰,则应在满意栏下注明部分标本受到干扰。
本图谱中的照片将展示多种细胞标本,其中包含有足够数量的鳞状物质和腺体物质。出于本主题的考虑,所采用的照片都包含有最低数量的细胞,并有过渡区细胞示例。
提示:可点击任何图片放大。
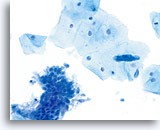
标本评估满意
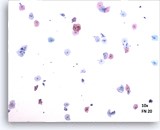
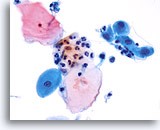
图示内容表示一个 10X 的显微视野,其中包含 60 个清晰可见/保存良好的鳞状细胞;这些细胞来自 ThinPrep 玻片,并具有足够的细胞量。
标本评估满意
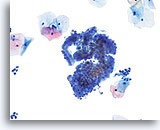
图示内容表示一个 10X 的显微视野,其中包含 50 个清晰可见/保存良好的鳞状细胞;这些细胞来自 ThinPrep 玻片,并具有足够的细胞量。
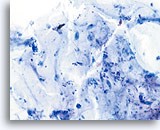
标本评估不满意
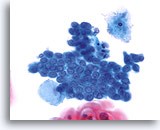
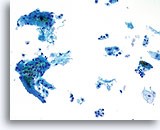
图示内容表示一个 10X 的显微视野,其中包含 40 个清晰可见/保存良好的鳞状细胞;这些细胞来自标本评估不满意的 ThinPrep 玻片。
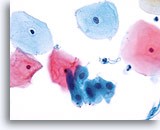
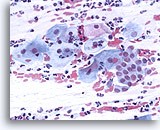
过渡区细胞
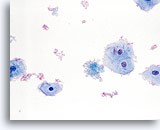
过渡区细胞由呈现栅栏和蜂窝状排列的颈管细胞组成。20X
过渡区细胞
过渡区细胞由细小的立方形颈管细胞组成,这些细胞的细胞核位于胞浆顶部。 40X
过渡区细胞
鳞状化生细胞表示的是过渡区细胞。 40X
过渡区细胞
鳞状化生表示的是过渡区。 40X
干扰因素
对标本鳞状细胞造成干扰的炎细胞。 20X
干扰因素
对鳞状细胞细胞量造成干扰的血细胞。40X
干扰因素
对鳞状细胞细胞量造成干扰的润滑剂。20X
干扰因素
对鳞状细胞细胞量造成干扰的粘液。20X
传统的巴氏涂片
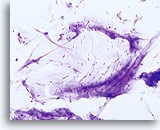
具有过渡区和鳞状细胞的传统巴氏涂片. 40X
ThinPrep 涂片检测
采用 ThinPrep 法为同一患者制作的标本。标本上呈现出鳞状细胞和腺体细胞. 40X
总之,无论采取何种方法制作标本涂片,都应遵守“美国国家临床实验室标准委员会”((NCCLS) 所推荐的且适用的涂片检测采集法标准;这是确保细胞标本量充足,并对患者情况做出正确诊断的基本要求。如果宫颈处聚积有炎细胞碎片、血细胞和粘液,并且未能正确清除,则这些聚积物会被采集下来,并会出现在玻片上。如果使用了润滑剂,则会在将细胞转移至玻片的过程中造成干扰。这样,玻片将不能反映患者的状况,并可能会导致误诊。
如果能以正确的方法进行采集,并能及时对采集装置进行彻底的漂洗,便能够在处理过程中将具有代表性的患者上皮标本转移至玻片上,从而使宫劲疾病的检测水平获得提高。
1.Bernstein SJ, et al: Liquid-based cervical cytologic smear study and conventional Papanicolaou smears: A metaanalysis of prospective studies comparing cytologic diagnosis and sample adequacy. Am J Obstet Gynecol 2001;185:308-17.
2.Bethesda 2001 Post workshop recommendations.
www.bethesda2001.cancer.gov.
3.Corkill M, et al: Specimen adequacy of ThinPrep sample preparations in a direct-to-vial study. Acta Cytol 1997;41:39-44.
4.Darragh TM, et al: Comparison of conventional cytologic smears and ThinPrep preparations from the anal canal. Acta Cytol 1997; 41: 1167-70.
5.Diaz-Rosario LA, Kabawat SE: Performance of a fluid-based, thin-layer Papanicolaou smear method in the clinical setting of an independent laboratory and an outpatient screening population in New England. Arch Pathol Lab Med 1999;123(9):817-21.
6.Guidos BJ, Selvaggi SM: Use of the ThinPrep Pap Test in clinical practice. Diagn Cytopathol 1999;20:70-73.
7.Haroon S, et al: Reproducibility of cervicovaginal ThinPrep® cellularity assessment. Diagn Cytolpathol 2002 jan;26(1):19-21.
8.Henry JA, Wadehra V: Influence of smear quality on the rate of detecting significant cervical cytologic abnormalities. Acta Cytol 1996; 40: 529-35.
9.Kivlahan C, Ingram E: Papanicolaou smears without endocervical cells. Are they inadequate? Acta Cytol 1986; 30: 258-60.
10.Mintzer MP, et al: The effect of the quality of Papanicolaou smears on the detection of cytologic abnormalities. Cancer Cytopathol 1999; 87: 113-7.
11.Mitchell HS: Longitudinal analysis of histologic high-grade disease after negative cervical cytology according to endocervical status. Cancer 2001;Aug 25;93(4):237-40.
12.Papillo J, et al: Evaluation of the ThinPrep Pap Test in clinical practice: a seven-month 16,314-case experience in northern Vermont. Acta Cytol 1998;42:204-208.
13.Renshaw AA, et al: Accuracy and reproducibility of estimating the adequacy of the squamous component of cervicovaginal smears. Am J Clin Path 1999; 111: 38-42.
14.Selvaggi SM, Guidos BJ: Specimen adequacy and the ThinPrep Pap Test: The endocervical component. Diagn Cytopathol 2000; 23(1):23-26.
15.Sherman ME, et al: Cytologic diagnosis of anal intraepithelial neoplasia using smears and Hologic Thin-Preps. Mod Path 1995; 8: 270-74.
16.Spires SE, et al: Assessment of cervicovaginal smear adequacy. The Bethesda system guidelines and reproducibility. Am J Clin Path 1994; 102: 354-9.
17.Timmerman TG, et al: Objective criteria to determine cellularity in the ThinPrep Papanicolaou test. Acta Cytol 1998; 42: 1242.
18.Valente P et al: The determination of Papanicolaou smear adequacy using a semiquantitative method to evaluate cellularity. Diagn Cytopathol 1991; 7: 576-80.